An effective approach to creating bird chimeras
An effective approach to creating bird chimeras
Abstract
Further progress in poultry breeding can be achieved by using modern biotechnology techniques such as cell engineering. Improvements in cell technologies allow the creation of chimeric organisms. Avian genetic chimeras can play an important role in the creation of new high-yielding genotypes, as well as in solving problems related to the preservation of genetic diversity in the bird population. The method of creating injected chimeras finds wide application in the field of cryobiology, experimental biology, toxicology and other areas of biology, veterinary science and agriculture. Creation of chimeric individuals enables understanding the interaction of different cell types derived from different organisms already at the early stages of embryogenesis. The most promising direction is the production of transgenic chimeric birds, when embryonic stem and primary sex cells are modified with subsequent transplantation into embryos. In the course of work using primordial cells, chimeric individuals of chickens with a specific type of plumage were obtained. The questions of further research aimed at increasing the efficiency of chimera creation in chickens and their use in genetic engineering research were discussed.
1. Введение
Химеры — это особи, состоящие из соматических тканей или тканей зародышевой линии, происходящих из более чем одной зиготы. Межвидовые химеры имеют ткани, полученные от разных видов. В последние десятилетия виды птиц стали основной целью изучения химер в результате их значительных достоинств. Модель тканевой химеры птиц очень важна для изучения фундаментальной биологии . Химеры зародышевой линии могут быть адаптированы для увеличения популяции исчезающих птиц или восстановления вымерших видов. С момента рождения Долли перенос ядер соматических клеток (ПЯСК) дал возможность клонировать находящихся под угрозой исчезновения животных. ПЯСК использовался для сохранения находящихся под угрозой исчезновения млекопитающих. Однако этот метод неприменим для птиц из-за физиологических различий. Перед яйцекладкой бластодермальные клетки птиц подвергаются интенсивной пролиферации. Когда яйцо откладывается, эмбрион содержит 40000–60000 бластодермальных клеток, многие из которых не дифференцированы. Трудно получить зиготы, которыми можно манипулировать. Таким образом, исходя из различий в эмбриогенезе, следует использовать разные стратегии для получения химер у птиц. Были попытки создать химеры птиц на более поздних стадиях. За исключением традиционной гибридизации и искусственного оплодотворения, некоторые клетки-кандидаты для производства химер в настоящее время считаются лучшими, например, бластодермальные клетки (БК), примордиальные половые клетки (ППК), эмбриональные стволовые клетки (ЭСК), эмбриональные половые клетки (ЭП-клетки) и клетки зародышевой линии, подобные стволовым клеткам. Кроме того, оптимизация доступной технологии важна для повышения эффективности производства химер.
Существует несколько способов создания химерных птиц. Самым распространенным экспериментальным подходом служит выделение донорских бластодермальных (недифференцированных) клеток cESCs, полученных из куриного эмбриона свежеснесенного яйца, их культивирование и трансплантация реципиентному эмбриону того же возраста с дальнейшей инкубацией до вылупления. Другим источником таких клеток являются примордиальные стволовые клетки (cPGCs), взятые непосредственно из эмбриона на ранней стадии (cPGCs) или из формирующихся гонад на более поздних стадиях развития (gPGCs) (рис. 1).
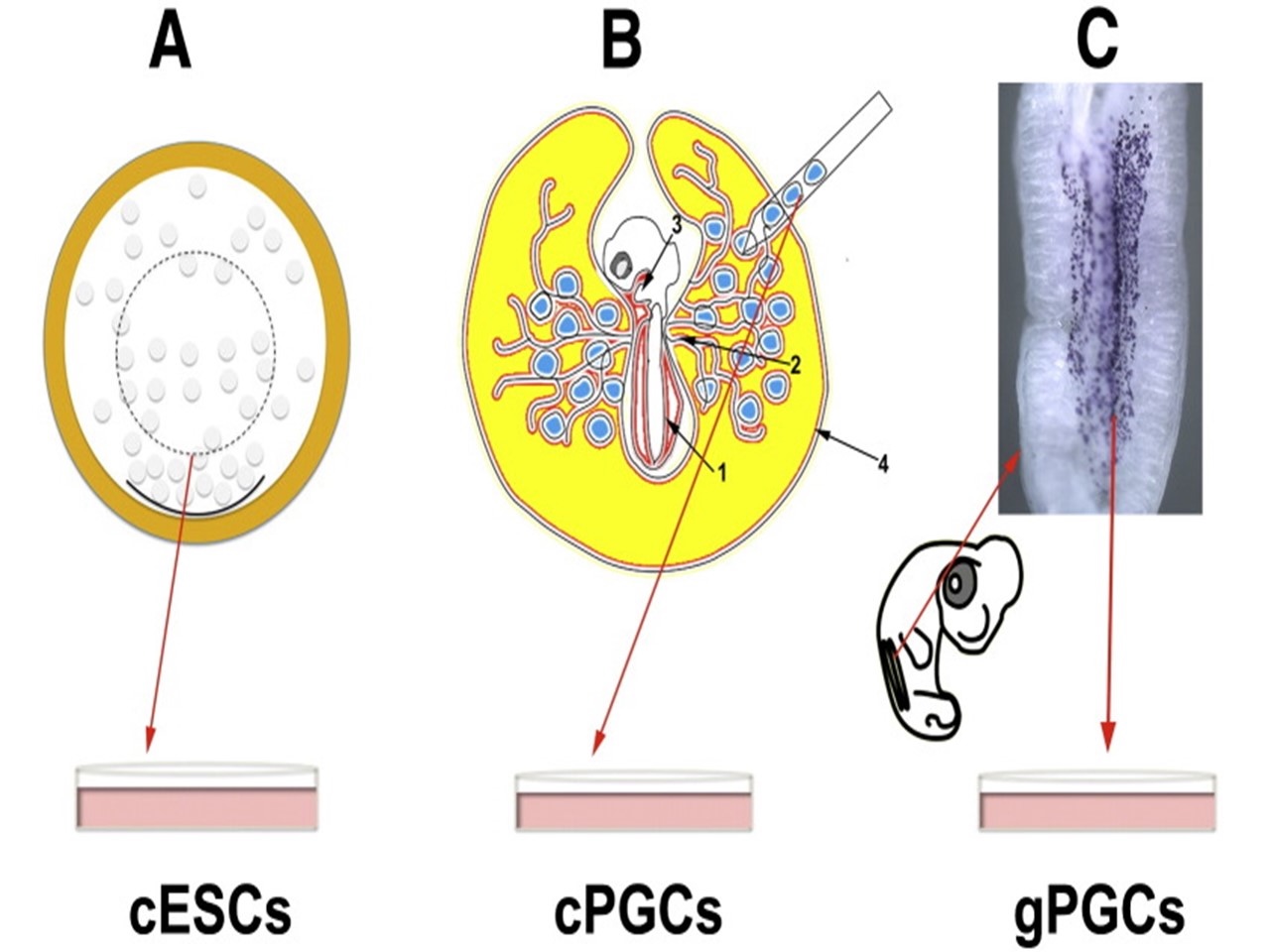
Рисунок 1 - Источники плюрипотентных стволовых клеток куриных эмбрионов на разных стадиях развития
Примечание: источник [2]
Необходимы дальнейшие исследования для повышения эффективности получения птиц донорского происхождения из химер зародышевой линии. Удаление эндогенных ППК из эмбрионов-реципиентов является одним из наиболее эффективных методов. Был предпринят ряд попыток уменьшить или устранить эндогенные ППК в эмбрионах-реципиентах и увеличить соотношение донорских ППК в гонадах эмбрионов-реципиентов. Облучение ультрафиолетовым светом, источником гамма-излучения или рентгеновскими лучами можно легко применить к эмбрионам-реципиентам.
Кроме того, хирургическое удаление бластодермальных клеток или ранней эмбриональной крови является доступным и проверенным методом уменьшения эндогенных ППК эмбрионов-реципиентов. Высококачественные химеры зародышевой линии и потомство были получены путем переноса донорских клеток реципиенту в отсутствие центральной части области пелюцида эмбриона. Удаление крови из ранних куриных эмбрионов также увеличивает скорость химеризма зародышевой линии. Эти два метода требуют высокого уровня навыков. Поэтому была разработана эффективная система доставки химического стерилизатора бусульфана для стерилизации цыплят-реципиентов. На основе эмульсии бусульфана, описанной K.M. Jung и др. , Y. Nakamura и др. разработали более эффективную систему доставки бусульфана с замедленным высвобождением, которая увеличивала эффективность эндогенного истощения PGC. Затем с использованием этой системы было получено большое количество потомства, полученного из донорских клеток .
Поскольку эмульсия с замедленным высвобождением имеет более низкую плотность, чем у желтка, этот носитель быстро поднимается, когда он вводится в желток, и контактирует с развивающимся эмбрионом, лежащим на вершине желтка. Основываясь на этих преимуществах, инъекция солюбилизированного бусульфана в эмульсии с замедленным высвобождением в желток приводит к последовательному и обширному истощению эндогенных ППК. Последующее исследование показало, что раннее применение бусульфана к эмбрионам-реципиентам позволяет снизить стерилизующий эффект остаточного бусульфана на донорские ППК. Донорские ППК, перенесенные в частично стерилизованные эмбрионы реципиента после введения бусульфана, были успешно включены в зародышевую линию реципиента (рис. 5) и дали начало функциональным гаметам. Тестовый перекрестный анализ показал, что скорость передачи по зародышевой линии у цыплят, получавших бусульфан, была значительно выше, чем в контроле (99,5% против 6,0%). Применение бусульфана достаточно подробно изучено в ряде работ , . Достоинством этого агента является тот факт, что он хорошо воздействует и на неделящиеся клетки, ингибируя развитие половых клеток. Высокие дозы бусульфана позволяют почти полностью вызвать стерильность гонад.
Были получены длительно культивируемые линии PGC цыплят и линии ППК .
2. Методы и принципы исследования
Объектами исследований в данной работе послужили породы кур русская белая и брама палевая в количестве 5 голов каждой породы. Опыты были проведены в лаборатории молекулярной генетики ВНИИ генетики и разведения сельскохозяйственных животных (г. Санкт-Петербург-Пушкин). Инъекционные химеры кур получены методом трансплантации бластодермальных клеток в эмбрионы реципиентов с помощью микроманипулятора. Из эмбрионов кур выделены бластодиски и отмыты в растворе фосфатно-солевого буфера (РН — 7,2), содержащего 0,125% трипсина и 0,02% ЭДТА. После ресуспензирования центрифугировали, супернатант удаляли, а суспензию клеток помещали в питательную среду следующего состава: питательная среда ДМЕМ (Sigma-Aldrich) с 10% фетальной сыворотки с антибиотиком гентамицином.
Культивирование клеток проведено при температуре 37 °С в течение 2 суток. Проведен морфологический анализ клеток с учетом мертвых и живых клеток, их пролиферации. Синхронно (по времени) в инкубаторе культивированы эмбрионы реципиентов. В яйцах реципиентов была сделана перфорация, через которую с помощью микроманипулятора введено разное количество суспензии клеток доноров. Далее их заклеили и поместили в инкубатор до стадии появления цыплят. Фенотип химер определен по изменению окраски оперения в возрасте от суток и далее.
3. Основные результаты

Рисунок 2 - Химерный петух
Таблица 1 - Влияние бусульфана на развитие эмбрионов
Количество бусульфана, нг/яйцо | Количество яиц, шт. | Выводимость яиц | |
количество | % | ||
150 | 5 | 1 | 20 |
250 | 5 | 2 | 40 |
350 | 5 | 3 | 60 |
450 | 5 | 3 | 60 |
0 (контроль) | 10 | 10 | 100 |
Таким образом, выводимость яиц в группах, где инъецировали 150 и 250 нг бусульфана, ниже, чем при более высоких концентрациях. Что может быть связано с негативным воздействием препарата на жизнеспособность клеток.
В группах, где инъецировали 250, 350 и 450 нг бусульфана на одно яйцо, у полученных цыплят в суточном возрасте определяли массу гонад. Оказалось, что тормозящий эффект бусульфана в концентрации 450 нг на пролиферацию клеток зародышевого пути наиболее выражен у самцов (рис. 3).
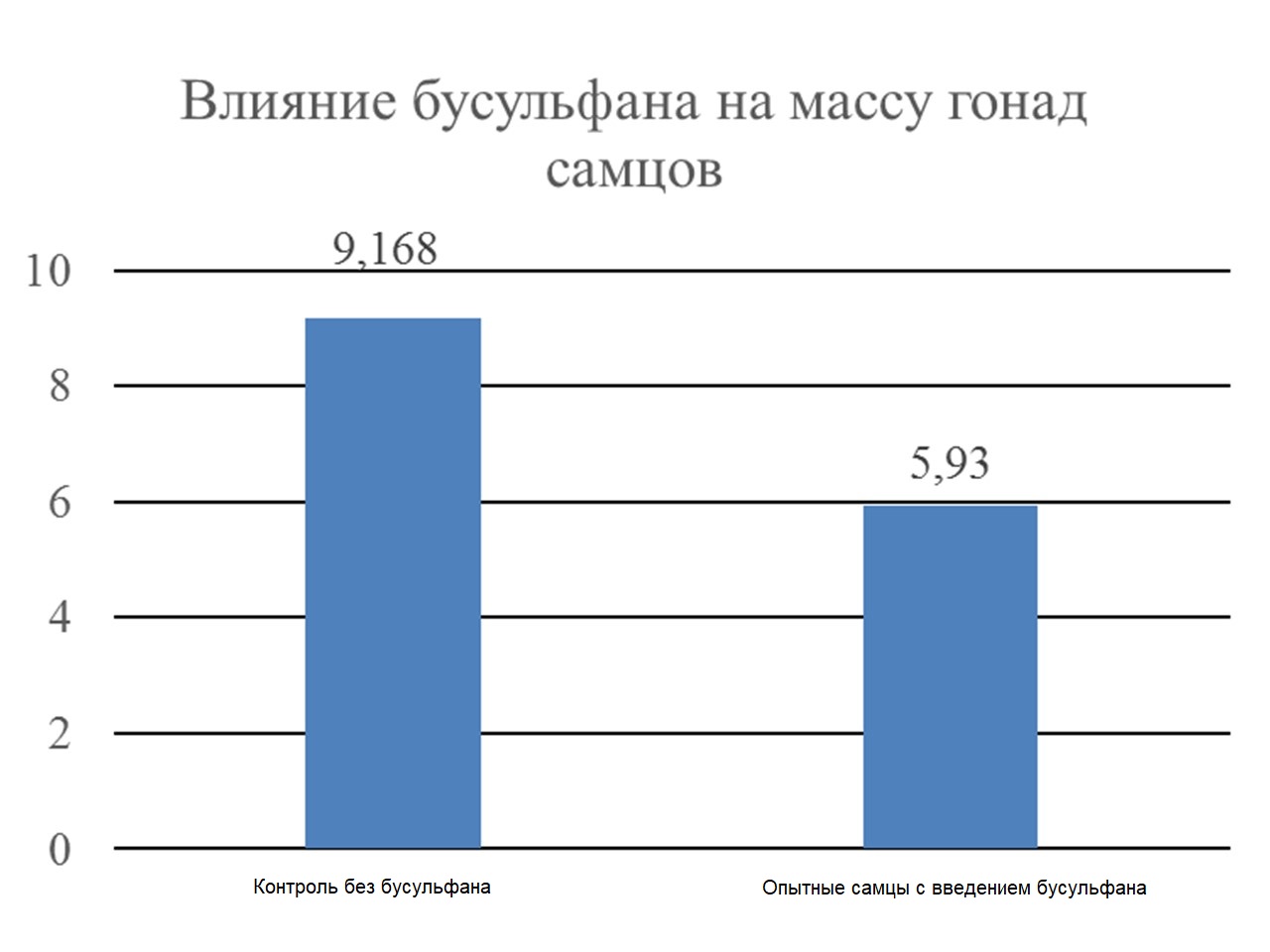
Рисунок 3 - Масса гонад у самцов
4. Заключение
Таким образом, инъекции примордиальных клеток, взятых от одной породы в эмбрион кур другой породы, приводит к появлению смешанного пула жизнеспособных клеток. Подавление деления эндогенных PGC бусульфаном является эффективным инструментом повышения доли инъецируемых клеток при развитии эмбриона, что проявляется в виде химерных особей, несущих клетки от разных пород. Показано, что воздействие бусульфана приводит к снижению массы гонад у самцов, что связано с тормозящим эффектом препарата на деление клеток зародышевого пути.
