Evaluation of tryptophan and trimethylamine N-oxide levels in neurological complications of Long COVID-19
Evaluation of tryptophan and trimethylamine N-oxide levels in neurological complications of Long COVID-19
Abstract
The aim of the research was to study plasma levels of tryptophan, trimethylamine N-oxide in patients with neurological complications of Long COVID-19.
Materials and Methods. The study included analysis of clinical data from patients' medical records, laboratory examination in 3 groups: "case" group – 15 people (patients who underwent COVID-19 in 2021-2022 and received rehabilitation medical care in the period of 6-12 months after recovery, who had 2 or more signs of Long COVID-19 with predominant nervous system disorders); "comparison" group – 15 people (patients who underwent COVID-19 in 2021-2022 and received rehabilitation medical care during 6-12 months after recovery, who did not have neurological manifestations); "control" group – 15 people (healthy volunteers who did not have a PCR-confirmed case of COVID-19, who did not have neurological manifestations). Laboratory studies included measurement of tryptophan, trimethylamine N-oxide levels using HPLC-MS/MS method.
Results and Discussion. The age-dependent tryptophan level was 5.13 µmol/L [3.01;6.08] in the "case" group, 6.10 µmol/L [5.43;7.03] in the "comparison" group and had a significant difference (p=0.002). The level of this amino acid was significantly higher in the "control" group, 8.96 µmol/L [7.34;12.39] and also had a statistically significant difference with the "case" and "comparison" groups (p=0.000). In case of TMA, its level was 0.94 µmol/L [0.55;2.09] in the "case" group and 0.55 µmol/L [0.40;0.79] in the "comparison" group and had a statistically significant difference (p=0.025). TMA level in the "control" group was 0.29 µmol/l [0.14; 0.39], also had a statistically significant difference with the "case" group – (p=0.01) and the "comparison" group – (p=0.07).
Conclusions. This study found statistically significant differences in tryptophan and trimethylamine N-oxide levels between the case, comparison and control groups, suggesting that these molecules are involved in the pathogenesis of neurological complications of Long COVID-19.
1. Введение
В Международной классификации болезней (МКБ) Long СOVID-19 был записан под кодом U09.9. Данное заболевание внесено как «состояние после COVID-19 неуточненное», которое включает в себя и постковидное состояние. На данный момент происхождение и патогенез симптомов Long COVID-19 остаются неясными. Но очевидно, что это совокупность прямого повреждения, вызванного вирусной инфекцией, сопутствующих заболеваний, иммунологического ответа, психологических и эмоциональных факторов .
Стало известно, что из числа пациентов, у которых длительные симптомы COVID-19 сохранялись в течение трех месяцев после первоначального заражения, у 15,1% симптомы сохранялись и по прошествии одного года; однако отдаленные последствия после COVID-19 после двенадцати месяцев еще недостаточно изучены .
Неврологические проявления составляют один из наиболее важных вариантов Long COVID-19 . Осложнения, влияющие на центральную нервную систему, включают усталость, затуманивание сознания, головную боль, нарушение сна, когнитивные и эмоциональные расстройства, головокружение и дизавтономию. Осложнения, влияющие на периферическую нервную систему, включают мышечную слабость, миалгию, аносмию, гипосмию, потерю слуха, нарушения восприятия, потерю тактильных ощущений, недомогание и тремор .
Вероятность возникновения неврологических осложнений при Long COVID-19 связана с повышенным индексом системного иммунного воспаления. К молекулам воспаления относятся интерлейкины бета-1,2, ФНО-альфа, гамма-интерферон .
Указанные провоспалительные цитокины и хемокины приводят к активации фермент индоламин 2,3-диоксигеназы (IDO), что ведет к снижению уровня триптофана и увеличению его метаболита — кинуренина, который является антагонистом серотонина . Серотонин — это гормон, играющий важную роль в различных функциях центральной нервной системы, таких как регуляция сна и настроения. Недостаток серотонина может вызвать расстройства сна и депрессию . Таким образом, активация IDO нарушает синтез серотонина, что может привести к возникновению психоэмоциональных нарушений.
Триптофан и его катаболизм по кинурениновому пути играет важную роль в воспалении и иммунном ответе, также рассматривается как один из предикторов возникновения тревожных и депрессивных расстройств и нарушений сна .
Другой молекулой, рассматриваемой в качестве диагностического показателя, для диагностики Long COVID-19, может быть использовано вещество триметиламин N-оксид (TMAO). Было обнаружено сходство между влиянием TMAO на иммунный ответ и коронавирусом. Исследователь Shi С. С. и соавт. установлено, что при взаимодействии коронавируса и инфламмасомы NLRP3 происходит усиленный синтез интерлейкина-1 и интерлейкина-18 за счет активации NF-B .
Согласно недавним исследованиям, TMAO также способен взаимодействовать с инфламмасомой NLRP3, активируя передачу сигналов NF-B и активных форм кислорода, индуцируя высвобождение провоспалительных цитокинов и способствуя развитию гиперинфламмасомных состояний .
Установлено, что ТМАО участвует в патогенезе COVID-19. Повышенные концентрации ТМАО играют определенную роль в развитии сердечно-сосудистых и хронических респираторных заболеваний, рака и диабета. Эти заболевания также являются факторами риска тяжелого течения COVID-19 .
Таким образом, неврологические осложнения Long СOVID-19 затрагивают центральную, периферическую, вегетативную нервную систему, приводя тем самым к инвалидизации, снижению социальной адаптации и, как следствие, к снижению трудоспособности, что ведет к отдаленным экономическим последствиям для страны, что делает актуальным продолжение изучения Long СOVID-19.
2. Методы и принципы исследования
Исследование «случай-контроль» проводилось на базе НАО «Карагандинского Медицинского Университета» научно-исследовательской лаборатории института наук о жизни, в соответствии с этическими принципами и после получения информированного согласия пациентов, протокол № 38 от 11.10.2022 года.
В данном исследовании участники были распределены в 3 группы:
I. Группа «случай» – 15 человек.
II. Группа «сравнения» – 15 человек.
III. Группа «контроль» – 15 человек.
Для включения в группу I «случай» (n=15) необходимо соответствие следующим критериям:
– госпитализация с диагнозом COVID-19 в течение последних 3 лет;
– наличие двух и более симптомов Long COVID-19, преимущественно с поражением нервной системы;
– отсутствие в анамнезе инфаркта миокарда;
– отсутствие воспалительных заболеваний кишечника в анамнезе;
– отсутствие противопоказаний для забора периферической венозной крови;
– добровольное согласие на участие в исследовании и подписанное информированное согласие.
Для включения в группу II «сравнения» (n=15) необходимо соответствие следующим критериям:
– госпитализация с диагнозом COVID-19 в течение последних 3 лет;
– отсутствие двух и более признаков Long COVID-19, особенно связанных с поражением нервной системы;
– отсутствие в анамнезе инсультов, травм головы или другой неврологической патологии;
– отсутствие перенесённого инфаркта миокарда;
– отсутствие воспалительных заболеваний кишечника в анамнезе;
– отсутствие противопоказаний для забора периферической венозной крови;
– добровольное согласие на участие в исследовании и наличие подписанного информированного согласия.
Для включения в группу III «контроль» (n=15) необходимо соответствие следующим критериям:
– отсутствие госпитализации по поводу COVID-19 за последние 3 года;
– отсутствие в анамнезе инсультов, травм головы или других неврологических заболеваний;
– отсутствие перенесённого инфаркта миокарда;
– отсутствие воспалительных заболеваний кишечника в анамнезе;
– отсутствие противопоказаний для забора периферической венозной крови;
– добровольное согласие на участие в исследовании и подписанное информированное согласие.
Критерии исключения:
1. Психические расстройства и тяжёлые неврологические заболевания.
2. Декомпенсированные или серьёзно протекающие соматические болезни.
3. Беременность.
В выборку исследования вошли 45 человек (от 26 до 75 лет). Из них 66,67% – женщин. Деформация структуры выборки по полу в определенной степени обусловлена имеющимся перевесом женского населения по сравнению с мужским, кроме того мужчины чаще отказывались от участия в исследовании.
В группу «случай» вошли пациенты, перенесшие COVID-19 в 2021-2022г и получавшие в период 6-12 месяцев после выздоровления реабилитационную медицинскую помощь, имевшие 2 и более признаков Long COVID-19 с преимущественными нарушениями нервной ткани.
В группу «сравнения» вошли пациенты, перенесшие COVID-19 в 2021-2022г и получавшие в период 6-12 месяцев после выздоровления реабилитационную медицинскую помощь, не имевшие неврологических проявлений. Дополнительно был произведен добор в группу «контроль» здоровых добровольцев, не имевших ПЦР подтвержденный случай COVID-19, без неврологических симптомов в анамнезе.
Биологический материал для ретроспективных групп «случай» и «сравнения» был использован из биологического архива (в глубокой заморозке) проекта BR 11065386-OT-22 «COVID-19: Научно-технологическое обоснование системы реагирования на распространение новых респираторных инфекций, включая коронавирусную инфекцию». Научный руководитель программы – д.м.н., Турмухамбетова А.А. (2021-2023 гг.).
Образцы плазмы крови были получены от пациентов контрольной группы в объеме 3 мл из вены натощак в пробирки, содержащие EDTA (BD Vacutainer, США). Далее через 15 мин после забора кровь центрифугировали при комнатной температуре в течение 10 мин при 2000 g. Затем 1,5 мл полученной плазмы разливали в пластиковые пробирки типа «Эппендорф», и замораживали при температуре -80°С. До проведения анализа пробирки с образцами хранились при температуре -80°С.
Определение концентраций триптофана и ТМАО в плазме пациентов проводилось с помощью метода высоко эффективной жидкостной хроматографии с масс-селективной масс-спектрометрической детекцией (ВЭЖХ-МС/МС).
Для статистического анализа использовали демоверсию программы STATISTICA. Анализ данных проводили при уровне значимости α=0,05. Проверку на нормальное распределение количественных данных осуществляли с использованием критерия Шапиро-Уилка. Описание количественных данных проводили на основе: медианы и квартилей. Для сравнения независимых выборок использовали метод Краскела – Уолиса и U критерий Манна-Уитни. Для оценки взаимосвязи уровней триптофана и ТМАО в группах был использован коэффициент корреляции Спирмена.
Этическое одобрение исследования было получено от этического комитета НАО «медицинского университета Караганды», протокол № 38 от 11.10.2022 года. Все участники исследования были информированы о целях исследования и подписывали письменное информированное согласие. Все данные об участниках были введены в базу, идентификаторы каждого из участников были закодированы.
3. Результаты и обсуждение
Из основной выборки, были сформированы 3 группы, по возрастному признаку, наличию неврологических симптомов и перенесенного COVID-19.
Группа обследованных лиц была представлена как мужчинами, так и женщинами. После формирования групп медиана возраста в общей популяции составила 59 лет (IQR 48;67).
В возрастных структурах у пациентов групп «случай» и «сравнения» преобладали пациенты пожилого возраста 53,3% и 73,3%. В группе «контроль» преобладали пациенты молодого возраста – 46,7% соответственно. При рассмотрении выборки по половому признаку, среди обследованных преобладали лица женского пола (66,67%).
Был проведен анализ историй болезней пациентов группы «случай», в ходе которого доминировали следующие неврологические симптомы: быстрая утомляемость (69%) и головокружение (22%). Также были обнаружены такие симптомы, как головная боль (15,6%), снижение памяти (9%), нарушение сна (6%), рассеянность внимания, отсутствие обоняния, шум в голове, слабость в мышцах/конечность и сонливость (3%).
Для проведения первичного описательного анализа показателей триптофана и ТМАО в зависимости от группы пациентов было проведено сравнение групп «случай», «сравнения» и «контроль» с использованием непараметрического метода Краскела – Уоллиса.
Таблица 1 - Оценка различий между уровнями триптофана и ТМАО у групп «случай», «сравнения» и «контроль»
Показатель | Группа «случай»* | Группа «сравнения»* | Группа «контроль»* | р |
Триптофан, мкмоль/л | 5,13 [3,01; 6,08] | 6,10 [5,43; 7,03] | 8,96 [7,34;12,39] | 0,000 |
ТМАО, мкмоль/л | 0,94 [0,55; 2,09] | 0,55 [0,40; 0,79] | 0,29 [0,14; 0,39] | 0,012 |
Примечание: *n=15; Мe [Q25; Q75]; р — статистическая значимость различий значений между группами, тест Краскела – Уоллиса
В результате проведенного анализа были выявлены статистически значимые различия между уровнями триптофана и ТМАО, и группами «случай», «сравнения» и «контроль». Уровень значимости при сравнении концентраций триптофана составил р=0,000.
При сравнении концентраций ТМАО между группами также были обнаружены статистически значимые различия – р=0,012.
В связи с этим было проведено попарное сравнение групп «случай», «сравнения» и «контроль» с использованием непараметрического U критерия Манна – Уитни.
Уровень триптофана в зависимости от возраста составил 5,13 мкмоль/л [3,01; 6,08] в группе «случай», 6,10 мкмоль/л [5,43; 7,03] в группе «сравнения» и имел значимое различие (р=0,002) (рисунок 1).
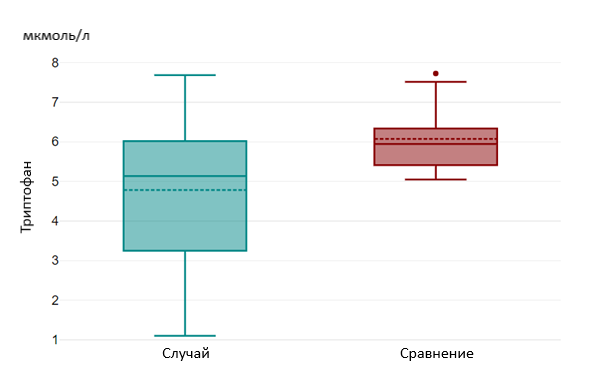
Рисунок 1 - Уровни триптофана в группах «Случай» и «Сравнение»
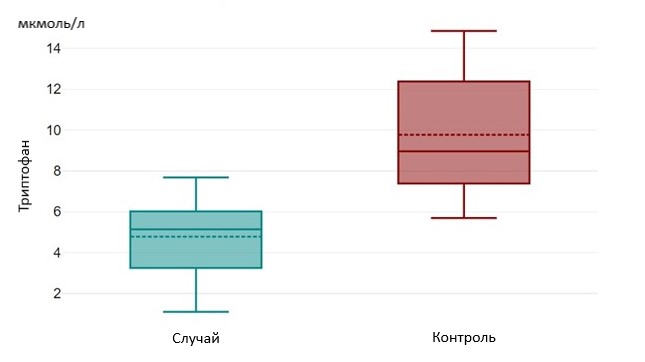
Рисунок 2 - Уровни триптофана в группах «Случай» и «Контроль»
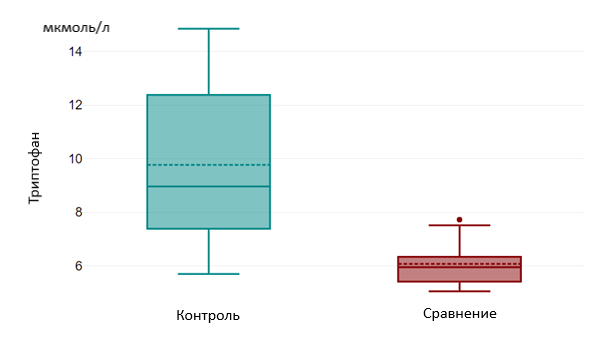
Рисунок 3 - Уровни триптофана в группах «Контроль» и «Сравнение»
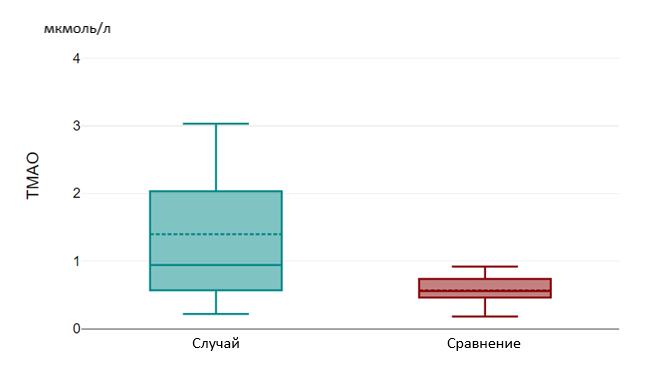
Рисунок 4 - Уровни ТМАО в группах «Случай» и «Сравнение»
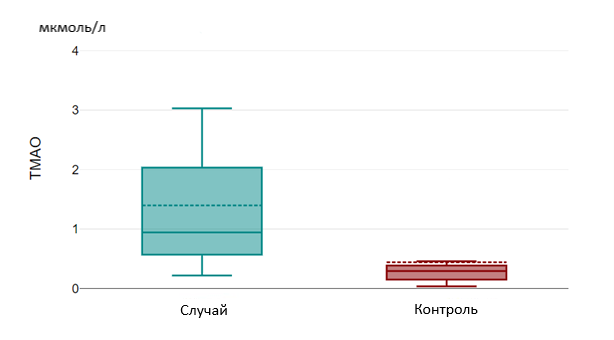
Рисунок 5 - Уровень ТМАО в группах «Случай» и «Контроль»
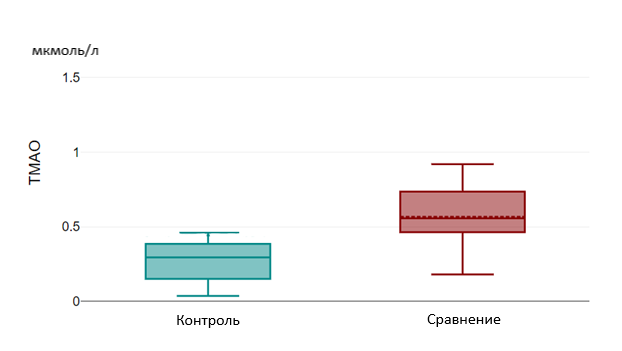
Рисунок 6 - Уровень ТМАО в группах «Контроль» и «Сравнение»
Также лица группы «случай» имели статистически более высокий уровень ТМАО по сравнению с группой «сравнения» (р = 0,025) и группой «контроль» (р=0,01), что обусловлено способностью ТМАО высвобождать провоспалительные цитокины и приводить к развитию гиперинфламмасомных состояний, повышать активность тромбоцитов, усиливать окислительный стресс и эндотелиальную дисфункцию, также снижать уровень оксида азота и нарушать синтез белков, обеспечивающих межклеточный контакт эндотелия, тем самым повышая проницаемость гематоэнцефалического барьера .
Таким образом, полученные результаты позволяют предположить, что изучаемые молекулы – триптофан и ТМАО принимают участие в патогенезе неврологических осложнений Long COVID-19 и перспективны для дальнейших исследований в области диагностики поражения неврологической ткани, в том числе по части возможных терапевтических воздействий.
4. Заключение
Были выявлены статистически значимые различия между уровнями триптофана и ТМАО, и группами «случай», «сравнения» и «контроль». Уровень значимости при сравнении концентраций триптофана составил р=0,000. При сравнении концентраций ТМАО между группами также были обнаружены статистически значимые различия – р=0,012. Уровень триптофана имел статистически значимое различие (р=0,002) между группами «случай» и «сравнения». Также уровень данной аминокислоты имел статистически значимое различие между группой «контроль» и группами «случай» и «сравнения» (р=0,000). Уровень ТМАО имел статистически значимое различие между «случай» и «сравнения» (р=0,025). В группе «контроль» ТМАО также имел статистически значимое различие между группой «контроль» и группами «случай» – (р=0,01) и «сравнения» – (р=0,07).
