SEGREGATION OF HAPLOID SETS OF CHROMOSOMES IN DIPLOID CELLS OF A NUMBER OF MAMMALIAN SPECIES
SEGREGATION OF HAPLOID SETS OF CHROMOSOMES IN DIPLOID CELLS OF A NUMBER OF MAMMALIAN SPECIES
Abstract
The architectonics of the interphase nucleus in diploid organisms has long attracted the attention of researchers due to its known tissue-specific differences, which suggest a significant contribution to the regulation of gene expression programmes. Its study has become especially important in recent decades due to the accumulated data that the sequential evolutionary process of genome size increase is not accompanied by a corresponding increase in the number of protein-coding genes, and most DNA markers, polymorphism of which is associated with the variability of phenotypic characteristics, are localized in non-coding DNA sequences. Significant progress has been made in studies of the architectonics of the interphase nucleus, and numerous studies have been published that highlight its multiple features, but knowledge of the spatial organization of diploid (maternal and paternal) genomes is still limited. In this regard, we have analysed the distribution of homologues in metaphase plates of bone marrow cells of a number of rodents, in bovine blood leukocytes, in a group of cell lines and sublines of embryonic fibroblasts of laboratory mouse lines C3H/He, C57BL/6, CBA/Ca, embryonic stem cell lines R1 (descendant of the 129/Sv-CP mouse line cross) and G1 (BALB/c mouse line). All metaphase plates were obtained without the use of drugs damaging the division spindle and affecting the positioning of chromosomes in their space. The data on the association of haploid sets of chromosomes into subplates that differentiate relative to each other and change their mutual position within a cell population of the same origin are obtained. Possible mechanisms of autonomous association of heterologous chromosomes into such subplastids and their potential significance for conjugation of homologues in meiosis and in the formation of polytene chromosomes are discussed.
1. Введение
Существенная роль архитектоники интерфазного ядра в организации программ генной экспрессии очевидна была еще со времен выявления тканеспецифичных особенностей в ее организации у многоклеточных организмов. Ряд из них является идентификационной характеристикой для разных клеточных типов, таких, например, как палочкоядерные, сегментоядерные нейтрофилы, мегакариоциты, безъядерные тромбоциты и эритроциты и некоторые другие. К настоящему времени опубликовано огромное количество исследований, в которых выделены множественные черты порядка хромосом в пространстве интерфазных ядер. К ним можно отнести следующие
.1. Индивидуальные хромосомы занимают автономный домен в пространстве интерфазного ядра, что препятствует «перепутыванию» эухроматиновых районов.
2. Районы хромосом с гетерохроматиновыми блоками часто ассоциируют друг с другом, образуя хромоцентры.
3. В большинстве клеточных типов отсутствуют прямые ассоциации между доменами гомологичных хромосом.
4. Позиция доменов интерфазных хромосом фиксирована небольшим количеством сайтов связывания с ядерной ламиной и другими сайтами кариоскелета.
5. Пространственное расположение центромерных районов (и перицентромерного гетерохроматина) специфичны для определенных клеточных типов. Передвижение центромер возникает в течение клеточного цикла, цитодифференцировки и при некоторых физиологических условиях.
6. Теломерные участки предрасположены к ассоциациям в некоторых типах соматических клеток и в профазе мейоза.
7. Различные этапы биогенеза рибосом происходят в строго определенном домене интерфазного ядра – в ядрышке. Топологически хорошо определяемая субструктура ядрышка необходима для транскрипции рДНК и процессинга пре-рРНК.
8. Имеются данные о компартментализации событий транскрипции и процессинга в большинстве исследованных ядер.
9. Репликация ДНК в ядре находится под строгим пространственно-временным контролем.
10. Пространственная организация некоторых семейств высокоповторенных последовательностей ДНК создает каркас интерфазного ядра, причем пространственные особенности такого каркаса могут отличаться у клеточных популяций разного направления дифференцировки у одного организма, но быть сходными в одинаковых клеточных типах даже у эволюционно удаленных видов
.11. Имеется порядок взаимодействий между негомологичными хромосомами, о чем свидетельствуют хромосомные перестроенные маркеры ряда опухолей, а также тканеспецифичная сближенность между хромосомами – участницами таких транслокаций вне опухолевых патологий
, , .В последние годы особое внимание уделяется вопросам взаимосвязей между распространением мобильных генетических элементов (транспозонов – ТЕ) и их влиянием на трехмерную организацию интерфазного ядра, формированию сетей регулома, начиная от дистантных взаимодействий между энхансерами – сайленсерами и промоторами, формирования топологически ассоциированных доменов хромосом (Topological-Associated Domains – TAD), включая изменчивость доступности к связыванию с факторами регуляции транскрипции определенных последовательностей ДНК (например,
, , , ).То есть накопление данных о влиянии первичных последовательностей мотивов ДНК, их полиморфизма и эпигенетической изменчивости на регуляцию генной экспрессии стремительно развивается, но в то же время недостаточно исследованными остаются вопросы о хромосомной архитектонике ядра, в частности, о взаимоотношениях гомологичных хромосом в диплоидных клеточных популяциях.
Контакты между гомологичными хромосомами хорошо известны в нескольких случаях – в мейозе, в клетках с политенными хромосомами, в том числе и у плацентарных животных в клетках трофобласта , а также в некоторых вариантах эндомитоза в клеточных культурах, в частности, при разрушении веретена деления колхицином (К-митозы).
В то же время взаимоотношения между гомологичными хромосомами в соматических диплоидных клетках до сих пор остаются дискуссионными. Так, например, на основе сравнительных данных профилей генной экспрессии у родительских особей и потомков скрещиваний мышей лабораторных линий C57BL/6J (самцы) и CAST/EiJ (самки) авторы делают вывод об определенной пространственной разобщенности гомологичных хромосом, что связано с аллель-специфичной экспрессией в разных участках гаплоидных наборов , . Описаны также факты дистантных взаимодействий (кластеризации) между геномными участками вне зависимости от гомологии в связи с активностью генной экспрессии .
Достаточно давно выдвигаются предположения о том, что в диплоидных клетках имеется компартментализация отцовских и материнских геномов, присутствующая на ранних стадиях развития эмбриона и сохраняющаяся во взрослом состоянии . Хорошо известны работы о такой компартментализации родительских геномов у гибридных растений . Однако на ряду с установленными данными о сходстве расположения гомологов по отношению к центру интерфазного ядра, метафазной пластинки, участия в TAD, отсутствуют достаточно обоснованные предположения о том, чем же может быть обусловлена неопределенность компартментализации гомологов и ее возможные механизмы .
В этой связи в настоящей работе представлены накопленные экспериментальные данные, позволяющие предполагать сохранение автономности гаплоидных наборов хромосом в пространстве ядер диплоидных клеток, ее возможные механизмы и причины трудностей ее выявления.
2. Методы и принципы исследования
В анализ сегрегации гаплоидных наборов хромосом включены клетки костного мозга трех видов полевок (рыжая полевка – Clethrionomys glareolus, полевка экономка – Microtus oeconomus; пашенная полевка – Microtus agrestis), суслика – Spermophilus suslicus, лабораторных линий мышей BALB/c, C57BL/6, которые получали путем вымывания из задних лапок гипотоническим раствором КС1 (0.54%). Для сравнения с мелкими мышевидными грызунами рассматривали лейкоциты крупных млекопитающих. При приготовлении клеток периферической крови крупного рогатого скота (симментальской и голштинской пород) кровь брали из яремной вены животных в стерильные гепаринизированные пробирки, краткосрочную культуру клеток крови готовили обычным способом на среде Хенкса-199 с добавлением антибиотиков (стрептомицин и пенициллин) и фитогемагглютенина, их культивировали на протяжении 72 часов в термостате при температуре 37°С. В анализ клеток, полученных от животных, включали не менее 3-х особей и не менее 60 метафаз.
С целью сопоставления сегрегации гаплоидных наборов хромосом в диплоидных клетках, полученных от животных, перечисленных выше, рассмотрены метафазные пластинки следующих клеточных линий, пассируемых in vitro. Все клеточные линии, сублинии и клональные сублинии эмбриональных фибробластов мышей СЗН/Не, C57BL/6 н СВА/Са на разных стадиях неопластической трансформации были получены, охаpактеpизованы по фенотипу и предоставлены нам для цитогенетических исследований д.б.н. В.А.Лавpовским , популяции клеток эмбриональной стволовой клеточной линии G1, полученной из эмбриона мыши линии BALB/c – д.б.н. Лукаш Л.Л. , эмбриональной стволовой клеточной линии R1 (потомок кросса линий мышей 129/Sv-CP) – д.б.н. Межевикиной Л.М.
. В каждой клеточной популяции строили кариограммы не менее 10-ти метафаз.Выделенные клетки инкубировали 30-40 мин. в гипотоническом растворе КС1 (0.54 %) при температуре +37 °С, фиксировали смесью метилового спирта и уксусной кислоты (3:1), окрашивали препараты красителем Гимза, далее их анализировали с помощью бинокулярного микроскопа (Motic) со встроенным цифровым фотоаппаратом при увеличении в 1000 раз. При приготовлении всех препаратов для исследований метафазных пластинок не использовали ни колхицин, ни колцемид, разрушающие веретено деления и влияющие на позиционирование хромосом в их пространстве.
Работа выполнена в лаборатории геномики ФГБНУ НИИПЗК.
3. Основные результаты

Рисунок 1 - Гаплоидный набор хромосом в клетке костного мозга мыши линии BALB/c
Примечание: G-бендинг; цифрами указаны номера хромосом
Известно, что искусственно полученные гаплоидные линии эмбриональных стволовых клеток (ЭСК) служат источником для геномного скрининга различных гаплотипов, активно делятся и могут быть достаточно стабильны в своем гаплоидном состоянии в процессе культивирования , . Может ли в норме возникать спонтанная гаплоидизация так, как это наблюдается в некоторых опухолевых клетках, остается неясным, так же как и механизмы подразделенности на гаплоидные геномы в полиплоидных опухолевых клетках .
Следующий экспериментальный факт, полученный нами ранее, заключается в том, что при индукции межхромосомных ассоциаций по типу робертсоновских транслокаций путем обработки мышей адирамицином обнаруживались ассоциации только между гетерологичными, но не гомологичными хромосомами, что позволило предположить пространственную разобщенность гаплоидных наборов .
Следует отметить дополнительную деталь. В большинстве случаев, несмотря на модальное количество хромосом, и в опухолевых клетках, и в клеточных линиях, маркерные для них транслокации, как правило, между гетерологичными хромосомами, встречаются в одной копии, что свидетельствует о фиксации такой перестройки только в одном гаплоидном наборе , . Спонтанная диплоидизация полиплоидных клеток у некоторых ESC в процессе культивирования, судя по одиночным хромосомным маркерам, тоже может происходить не за счет прямого возвращения полиплоидных клеток к митозу, а в результате межклеточных слияний гаплоидных клеток, выделившихся в таких митозах .
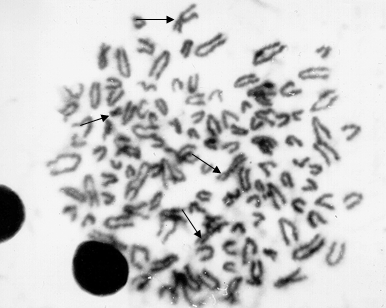
Рисунок 2 - Метафазная пластинка бычка симменальской породы, рожденного в двойне с телочкой
Примечание: полиплоид (120 хромосом), гематологический химеризм, половые хромосомы ХХХУ указаны стрелками
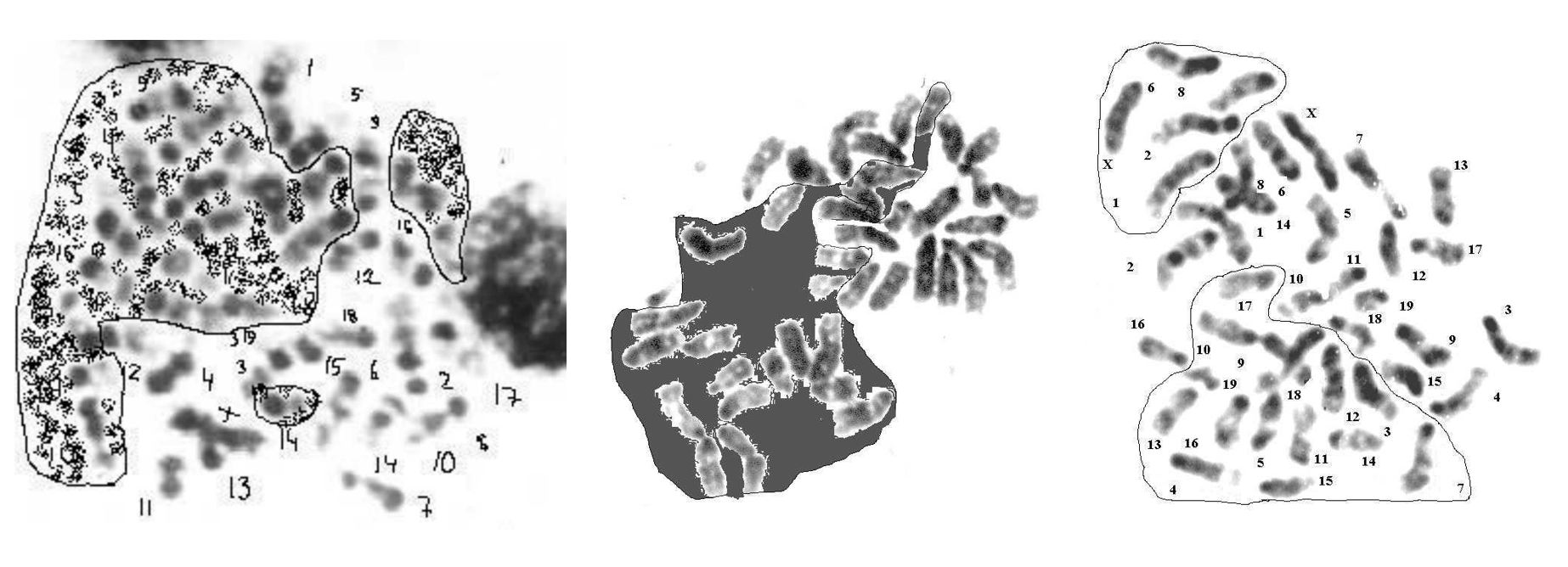
Рисунок 3 - Метафазные пластинки костного мозга мыши линии C57BL/6
Примечание: менее плотно упакованные гаплоидные наборы выделены фоном, обведены линиями; G-бендинг
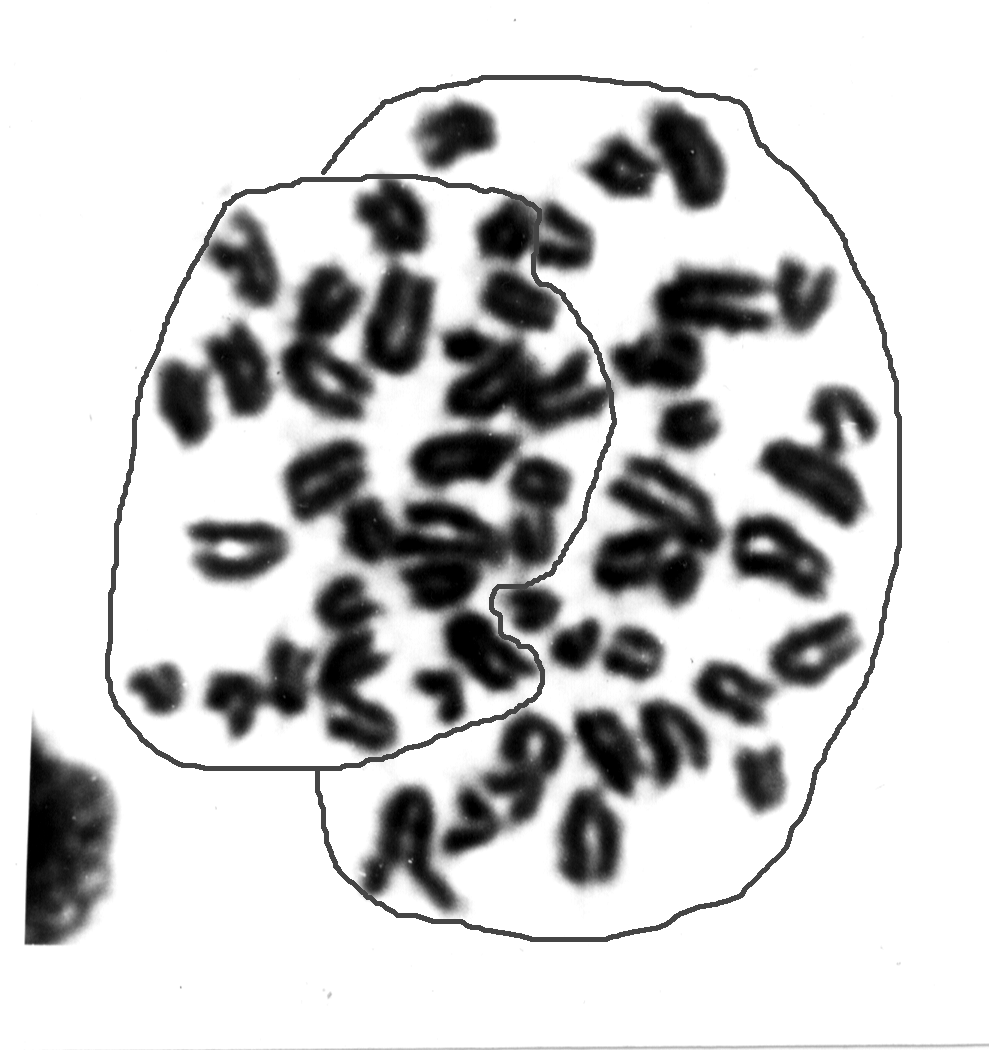
Рисунок 4 - Диплоидные метафазы клеток костного мозга с выделением внутренней подразделенности на гаплоидные субпластинки
Примечание: линиями обведены гаплоидные наборы хромосом
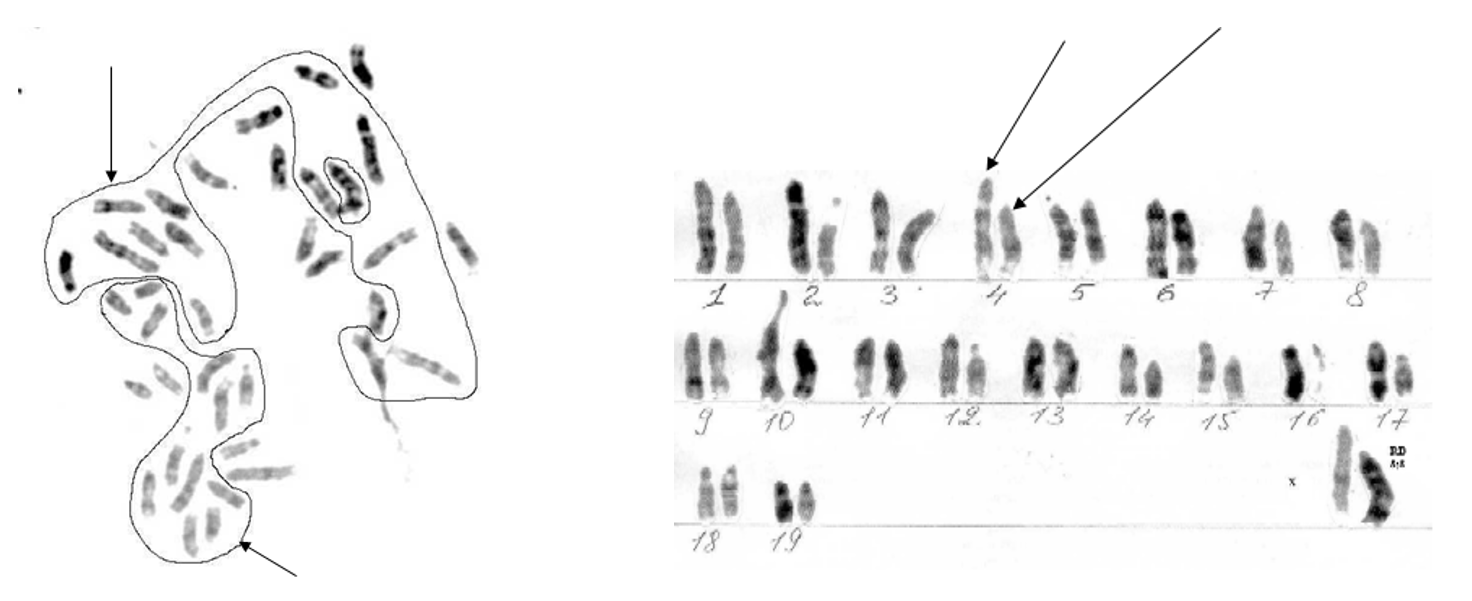
Рисунок 5 - Метафазная пластинка R1.5 со спонтанным G-бендингом
Примечание: нет хромосомы У, присутствует робертсоновская транслокация 8;8; тетрасомия по материалу хромосомы 8; количество хромосом соответствует нормальному диплоидному набору мыши 2n=40.; гомологи существенно отличаются по длине; в метафазной пластинке гаплоидные наборы, объединяющие крупные и мелкие гомологи, выделены линией и указаны стрелкой (верхняя стрелка над метафазной пластинкой – обведены крупные гомологи, нижняя – относительно более короткие)
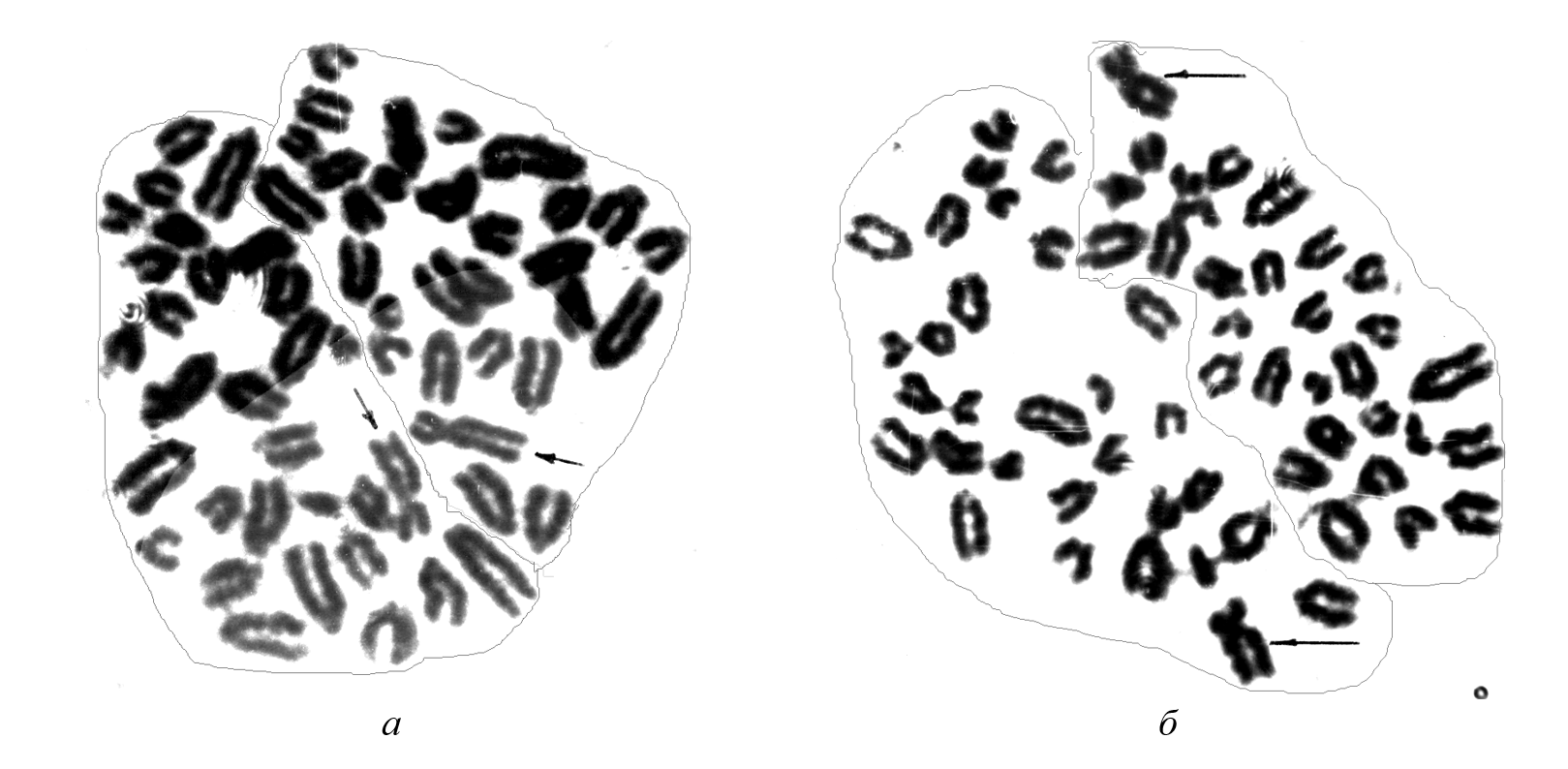
Рисунок 6 - Взаимное расположение пары хромосом Х (указаны стрелками) в метафазных пластинках периферической крови крупного рогатого скота:
а – близкое расположение, антипараллельное; б – максимально удаленное, параллельное расположение
Примечание: линией обведены условно гаплоидные наборы хромосом
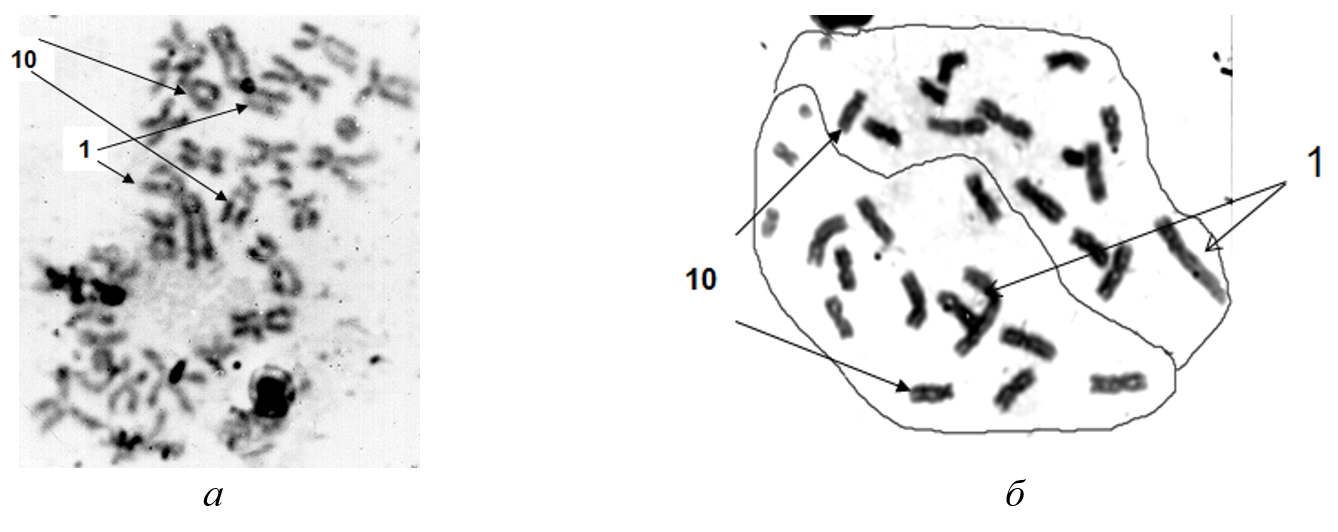
Рисунок 7 - Метафазные пластинки костного мозга (Microtus oeconomus):
а - разобщенные гаплоидные наборы хромосом, антипараллельное расположение пары хромосом 1 (Хр) и сходное - пары хромосом 10 (обозначены стрелками); б - метафаза с параллельным расположением гомологов хромосомы 1, пара гомологов Хр 10 разобщены и почти параллельны (обозначены стрелками)
Примечание: линией обведены гаплоидные наборы Хр
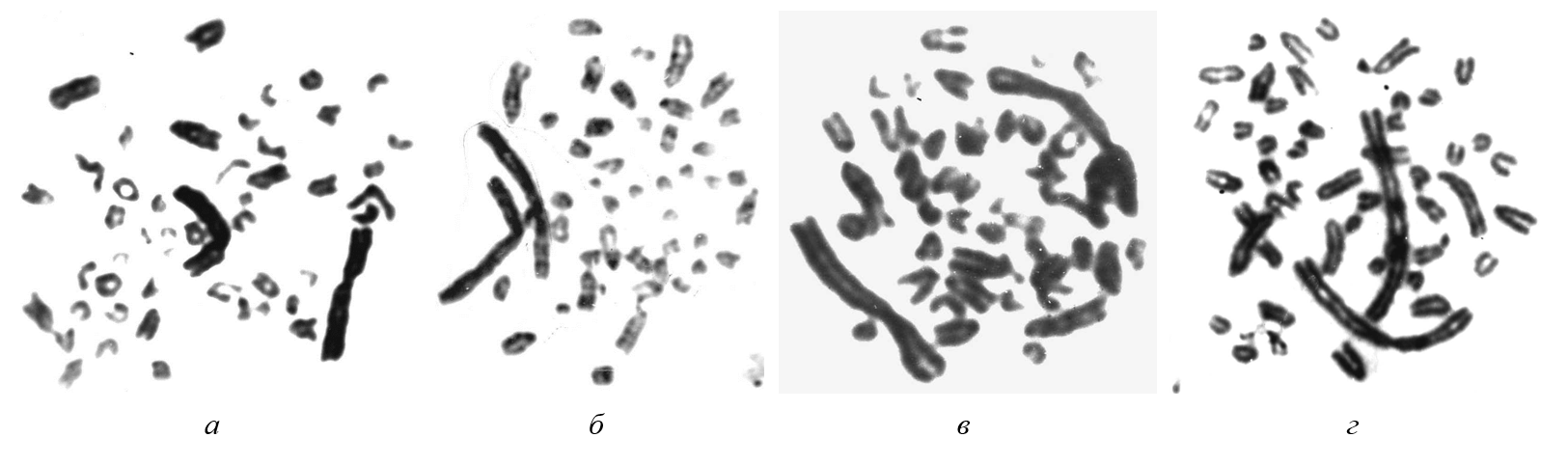
Рисунок 8 - Метафазы пашенной полевки (Microtus agrestis):
а, б – антипараллельное расположение пары хромосомы Х; в, г – параллельное расположение пары хромосомы Х
Примечание: крупная субметацентрическая хромосома Х в несколько раз больше самой крупной аутосомы
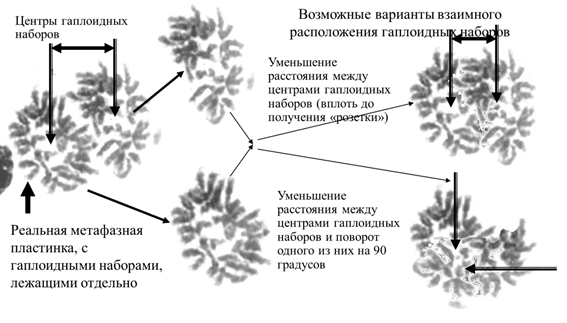
Рисунок 9 - Пример подразделенности на два гаплоидных субпластинок диплоидной метафазной пластики клетки костного мозга мыши и реконструкция из них типичных метафаз, получаемых при подготовке клеток к исследованиям с использованием препаратов, нарушающих веретено деления
4. Обсуждение
На основании накопленных данных становится очевидным, что гаплоидные геномы в диплоидных клетках формируют гаплоидные наборы хромосом, отделенные друг от друга, причем взаимоотношения внутри такого набора много «прочнее», чем между ними. Формируемые гаплоидные метафазные пластинки могут вращаться одна относительно другой (рис.9).
Справедливость этого предположения подтверждается еще и тем, что взаимоотношения между такими гаплоидными субпластинками хромосом, в частности, в мейозе, могут вести себя как моногенный признак. Так, у гексаплоидной пшеницы хорошо известен ген Ph1, мутации по которому приводят к гомеологичной коньюгации между хромосомами в профазе первого мейотического деления . Ген Ph1 связан с семейством киназ CDK2 , дефекты которых приводят к нарушению конъюгации гомологов в мейозе и у млекопитающих . Уже из того следует, что коньюгация между гаплоидными геномами как при полиплоидии, так и в мейозе в своем начале происходит не между индивидуальными хромосомами, а между их гаплоидными сообществами, формирующими структуры, в определенной степени автономные.
Кажется очевидным, что хромосомные ассоциации между гетерологами вовлекают относительно большую часть геномов внутри гаплоидных наборов, учитывая множественность контактов TAD и регуляторные сети, элементы которых одновременно взаимодействуют с участками разных гетерологов в процессе формирования сетей генной экспрессии, по сравнению с количеством хромосомных районов, участвующих в формировании контактов между хроматином и цитоскелетом. Это следует из данных об ограниченном количестве специализированных геномных элементов, вовлеченных в контакты с периферией ядра при сближении гомологов на премейотических стадиях . Интересно отметить, что контакты между гетерологами по теломерным и центромерным районам в диплоидных соматически клетках достаточно низки по сравнению с интерстициальными связями . То есть взамодействия между хромосомами в пространстве интерфазного ядра определяется балансом, в основном, двух сил – связями хромосом с периферией ядра (с ламиной, комплексом белков ядерной оболочки, ядерных пор, Linker of Nucleoskeleton and Cytoskeleton - LINC) и контактами между хромосомами, что, в общем, согласуется с полученными нами ранее данными на ядрах с политенными хромосомами , а также с изменениями положения гетерохроматиновых блоков относительно периферии и центра интерфазных ядер, описанных в специализированных клетках цилиндрических фоторецепторов ночных млекопитающих .
Механизмы формирования относительной автономности таких гаплоидных сетей, очевидно, могут быть связаны с известными отличиями во множественных РНК спектрах, обусловленных исходными половыми особенностями хромосомного импринтинга, профилей некодирующих РНК, привносимыми в зиготу вместе с гаметами, с экспрессией некоторых генов половых хромосом, избегающих, в частности, у хромосом Х лайонизации. Роль целого спектра РНК в архитектонике интерфазного ядра подробно рассмотрена в работе , совокупность таких РНК авторы обозначили как «архитектурная» РНК. Следует отметить, что у целого ряда животных сельскохозяйственных видов, например, в мышцах крупного рогатого скота, описана аллель-специфичная экспрессия, которая может быть связана с влияниями таких «архитектруных» РНК ,, .
Зависимость программ генной экспрессии от влияния окружающей среды на клеточную геометрию, клеточный цитоскелет, хорошо известна, на этом основана архитектоника тканей и органов, контактное торможение клеточного деления и его снижение при неопластической трансформации клеток, возможность реверсии опухолевого фенотипа клеток путем увеличения их адгезии к искусственным субстратам, переход эпителиальных клеток в мезенхимные по ряду фенотипических и метаболомных характеристик и т.д. , . В организации приема сигналов цитоскелета от факторов окружающей среды и его передаче к нуклеоскелету принимает участие огромное количество белков, элементов регуляторных сетей их экспрессии, между которыми достаточно сложно выяснить иерархические взаимоотношения, ключевые факторы и мишени их действия.
5. Заключение
На основании накопленных данных можно выделить несколько закономерностей на уровне элементов надхромосомной организации. Судя по сегрегации гаплоидных наборов в метафазных пластинках диплоидных клеток у разных видов млекопитающих и индукции гаплоидии соматических клеток путем преждевременного деления клеток , преимущество формирования межхромосомных транслокаций между гетерологичными хромосомами по сравнению с гомологами, подразделенность в ядре на гаплоидные сети сохраняется и во взрослом состоянии. Нет фиксированного положения гомологов по отношению друг к другу (пространственной близости, антипараллельности), за исключением дистанций относительно центра. Гаплоидные субпластинки, состоящие из гетерологов, могут вращаться относительно друг друга. Вращение, относительно повышенная внутренняя «прочность» гаплоидных субпластинок по сравнению со связями между ними, позволяет полагать, что события близкого их расположения или конъюгации (мейоз, политения) реализуется в результате контроля взаимного расположения не индивидуальных хромосом, а гаплоидных субпластинок, в котором принимают участие циклин-зависимые киназы (в частности, CDK2). На основании известных половых отличий по хромосомному импринтингу, спектров РНК, можно ожидать, что именно они и вносят свой вклад в «архитектурную» РНК, формирующую гаплоидные субпластинки гетерологичных хромосом в метафазах и обеспечивающую определенную автономность гаплоидных сетей в интерфазных ядрах.
Гаплоидные клетки могут встречаться у взрослых животных, в клеточных линиях и, по-видимому, участвовать в межклеточных слияниях, что может способствовать при спонтанной диплоидизации полиплоидов формированию клеток с одинаковым или близким числом хромосом, но с отличиями в хромосомном составе.
